随着世界经济发展和能源供求关系的日益尖锐,消费电子产品、电动汽车和储能电网等对锂离子电池的需求日益增加。传统的锂离子电池主要使用液态电解质作为锂离子传导介质,使得电极在充放电过程中更容易与电解液发生副反应和容量快速衰减,以及在长期使用后液体电解质会严重损耗,严重地影响了锂离子电池的使用寿命[1-2]。此外,液态锂离子电池存在严重的安全风险,特别是在过充、电解液泄漏、内部短路等不安全因素下会引发电池起火、甚至发生爆炸,极大地阻碍了液态锂离子电池的进一步发展[3]。近年来,固态电池由于具有高安全和高能量密度的优点而备受学术界和工业界的关注,已成为新能源新材料领域的研究热点。固态电池与液态电池的主要不同之处在于使用固体电解质替换了液体电解液,这样不仅避免了电解液引起的副反应和泄露等不安全因素的出现,从而提高了电池的安全性,而且可以减少隔膜、电解液等耗材的使用,以及匹配高能量密度正负极可提升电池能量密度[4-5]。目前,固体电解质主要分为聚合物、氧化物、硫化物和有机/无机复合型固体电解质四大类。其中,作为氧化物电解质的一种,石榴石型电解质锂镧锆氧(Li7La3Zr2O12,LLZO)室温下具有高的离子电导率(10-4~10-3 S/cm),宽的电化学电压窗口(约6 V),以及与锂金属优越的电化学稳定性,而成为了研究人员的重点研究对象[6-8]。
然而,LLZO石榴石固体电解质与正极、锂金属负极均为固体材料,LLZO石榴石固体电解质与正负极之间在组装电池时均为固固点对点接触,会导致石榴石型固态电池存在较大的界面阻抗,从而引发极化电压增大和降低充放电容量,甚至会造成石榴石基固态电池不能正常运行,阻碍了石榴石基固态电池的进一步应用和发展。因此,世界各国的科学家对石榴石型固态电池的界面问题做了大量的研究。美国马里兰大学胡良兵教授等发现在石榴石型固体电解质表面沉积一层界面层(Al2O3、Si、Mg、Al)[9-12],然后将其与熔融锂金属接触,由于界面层与熔融锂金属具有较好的浸润性,使得石榴石型固态电解质与锂金属负极的固固接触变好,极大地减少界面阻抗和提高石榴石型固态电池的循环稳定性。此外,美国德克萨斯州大学奥斯汀分校教授,同时也是2019年化学诺贝尔奖得主Goodenough等[13]在石榴石固体电解质与正负极之间中沉积一层交联的聚乙二醇甲基醚丙烯酸酯聚合物电解质,形成三明治结构的电解质,有效地解决了石榴石固体电解质与正负极之间固固界面接触的问题,组装的LiFePO4/Li全固态电池可以循环超过640次,并获得99.8%~100%较高的库仑效率。另外,上海硅酸盐研究所的温兆银研究员等[14]在石榴石电解质表面简单的酸盐处理,构建了一层三维交联LiF-LiCl网络界面层,然后将其与熔融锂金属接触,由于三维界面层与熔融锂金属具有较好的浸润性,石榴石固态电解质与锂金属负极的接触变好,组装的对称电池显示出了较小的界面阻抗(11.6 Ω·cm2),与LiFePO4和LiNi0.6Co0.2Mn0.2O2正极匹配时获得了较好的倍率和循环稳定性。这些研究表明,通过在石榴石电解质表面构建固相的界面层,可以降低界面电阻,从而有效地解决固态电池的界面接触问题。然而,利用少量电解液作为界面层降低石榴石型固态电解质与电极界面电阻的研究仍然比较少。
基于此,为了解决固态电解质与电极之间的界面接触问题,我们采用液态电解液作为界面修饰层,它主要起到增强石榴石电解质与锂金属之间的接触和减小两者之间界面阻抗的作用。我们以常规液体电解液作为界面层,石榴石电解质Li6.5La3Zr1.5Ta0.5O12(LLZTO)为电解质和锂金属组装成锂对称电池,研究了对称电池在液体电解液的浸润下循环前后的界面阻抗变化以及温度变化对界面阻抗的影响,该研究结果为常规电解液在固态电池中使用的普适性和兼容性提供了很好的参考。
1 实验材料与方法
1.1 LLZTO石榴石电解质陶瓷片的制备
采用固相法制备Li6.5La3Zr1.5Ta0.5O12(LLZTO)石榴石电解质陶瓷片。原料为:碳酸锂(Li2CO3,99.99%,Alfa Aesar),氧化镧(La2O3,99.99%,Alfa Aesar),氧化锆(ZrO2,99.99%,Sigma-Aldrich),氧化钽(Ta2O5,99.99%;Sigma-Aldrich)。按照LLZTO的化学计量比称取一定量的Li2CO3(10%过量),La2O3(预干燥处理:900 ℃保温15 h),ZrO2,Ta2O5四种材料放入球磨罐中,然后在高能球磨机中球磨2 h,取出放入坩埚中在空气炉中950 ℃保温12 h,随后取出得到的粉体球磨2 h然后压成直径为17 mm的小圆片,最后放入空气炉中且用母粉覆盖在1300 ℃保温10 min即可得到立方相的LLZTO电解质陶瓷片,烧结后的LLZTO直径约为14.86 mm。值得注意的是,在使用LLZTO电解质片之前需将其打磨到一定的厚度,然后用异丙醇清洗干净。
1.2 材料物性表征
采用布鲁克(Bruker)公司的X射线衍射仪(Smartlab,Cu-Kα radiation,9 KW)研究材料的晶体结构;采用扫描电子显微镜(SEM)和X射线能谱仪(EDS,Tescan mira3,Oxford,Czech Republic)研究材料的微观形貌和元素分布;采用X射线光电子能谱仪(XPS)(SSI SProbe,Al Ka=1486.6 eV radiation,72 W,12 kV)分析表面的元素价态变化;采用电化学工作站(Solartron 1260A+1470E,England)采集电池的电化学阻抗谱(EIS)数据;采用充放电仪(CT-4000,深圳市新威尔电子有限公司)测试对称固态电池恒流充放电数据;采用台式微机电导率仪(DDS-307型,厦门亿恩达科技有限公司)测试液体电解液的离子电导率;利用超级净化手套箱[威格气体纯化科技(苏州)股份有限公司,系列号:Vigor]组装扣式固态电池。
1.3 扣式对称固态电池的组装及测试
扣式固态对称电池的组装过程如下:首先,取适量(5、10、15 μL)的液体电解液(LE)滴在LLZTO陶瓷片一侧的表面,静置10 min后,接着将直径为14 mm的锂金属贴在LLZTO陶瓷片表面,然后在LLZTO陶瓷片的另一侧表面滴加同样量的电解液,静置10 min后,将直径为14 mm的锂金属贴在LLZTO陶瓷片表面,形成三明治结构的Li/LE-LLZTO-LE/Li。最后选取CR2032电池模具,先将直径为16 mm的泡沫镍放在负极壳中,接着把三明治结构的Li/LE-LLZTO-LE/Li放在泡沫镍上,然后放上钢片和正极壳封装,封装的压力需适中以避免LLZTO陶瓷片被压碎,封装好的对称电池静置24 h后进行恒流充放电测试。其中电解液的成分为1 mol/L LiPF6溶解于体积比为1∶1的EC和DMC以及10%质量比FEC的混合溶剂[1 mol/L LiPF6,EC+DMC(体积比1∶1)+10%FEC(质量分数)],根据实际的效果我们最后选用电解液的量为10 μL,这是因为10 μL的电解液刚好可以平铺浸润14.86 mm大小的LLZTO电解质陶瓷片,而5 μL太少不足以浸润,15 μL的电解液则太多以至于溢出。选取常规电解液主要考虑它作为常规电解液在固态电池中使用的普适性和兼容性。
2 实验结果与讨论
2.1 LLZTO石榴石电解质的晶体结构、离子电导率及液体电解液的离子电导率
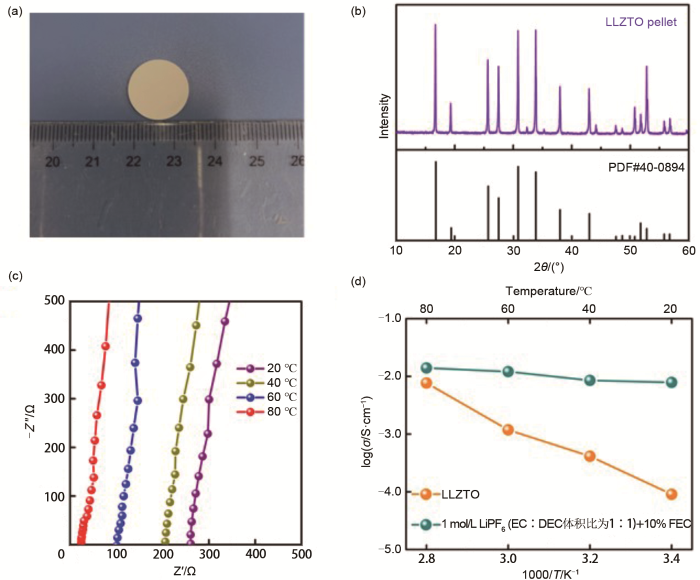
图1(a)为LLZTO石榴石固体电解质的光学照片及其XRD图,从光学照片可以发现LLZTO呈白色,直径约为14.86 mm,比烧结前直径减小(LLZTO原片直径为17 mm),原因是在高温1300 ℃烧结后出现体积收缩。图1(b)为LLZTO石榴石固体电解质的XRD图,如图1(b)所示,样品的XRD在2θ=16.777o、19.407o、25.726o、30.840o、33.862 o、37.999o、43.015o、47.568o、48.650o、50.764o、51.783o、52.813o、55.805o和56.743o出现了主要衍射峰,与立方相LLZTO的PDF卡片号(45-0109)的对应一致,无明显的杂质衍射峰出现,这较好地说明了制备得到的样品为纯立方相LLZTO。
图1
图1
(a) LLZTO石榴石电解质的光学照片;(b) LLZTO石榴石电解质的XRD图;(c) LLZTO石榴石电解质在不同温度下的EIS谱图;(d) LLZTO和电解液在不同温度下的离子电导率
Fig. 1
(a) digital image of LLZTO garnet electrolyte; (b) XRD pattern of the garnet LLZTO electrolyte;(c) Nyquist plots of LLZTO garnet electrolyte at different temperatures; (d) ionic conductivity of LLZTO and liquid electrolyte at different temperatures
利用交流阻抗法测定不同温度下LLZTO离子电导率,利用台式微机电导率仪测定不同温度下液体电解液的离子电导率,其中测试LLZTO电解质电导率时,LLZTO的表面进行涂敷银浆处理,处理后得到Ag/LLZTO/Ag对称电池,离子电导率的测定温度分别为20、40、60和80 ℃,LLZTO固体电解质的交流阻抗谱图如图1(c)所示,其在20、40、60和80 ℃的温度下的阻抗值分别为253.2、203.2、100.3和24.5 Ω·cm2,随温度增加电解质的阻抗值逐渐降低,表明升高温度有助于提升固体电解质中的锂离子传输能力。利用台式微机电导率仪测定不同温度下液体电解液的离子电导率,电解液的成分为1 mol/L LiPF6溶解于体积比为1∶1的EC和DMC以及10%质量比FEC的混合溶剂[1 mol/L LiPF6,EC+DMC(体积比1∶1)+10%FEC(质量分数)],测试LLZTO电解液电导率时,将台式微机电导率仪测试头插入装有电解液的玻璃容器中密封好放入油浴中,调整离子电导率的测定温度分别为20、40、60和80 ℃,每个温度点保温10 min后测试其离子电导率。LLZTO和液体电解液的离子电导率如表1所示,LLZTO在20、40、60和80 ℃的离子电导率分别为9.07×10-5、4.64×10-4、1.18×10-3、7.67×10-3 S/cm;而液体电解液在20、40、60和80 ℃的温度下的离子电导率分别为2.86×10-3、8.51×10-3、1.21×10-2、1.40×10-2 S/cm。如图1(d)所示,对比LLZTO和液体电解液的离子电导率,可以发现,LLZTO整体离子电导率呈现线性的趋势变化,说明随着温度的升高LLZTO的离子电导率逐渐升高,而液态电解液整体离子电导率呈平缓的变化趋势,说明液体电解液随着温度的变化其离子电导率变化不大,液体电解液在不同的温度下比LLZTO石榴石电解质仍具有明显的优势,这也是选取液体电解液作为LLZTO固态电池界面修饰层的主要原因。
表1 LLZTO石榴石电解质和液体电解液在不同温度下的离子电导率 (S/cm)
Table 1
| 温度/℃ | 20 | 40 | 60 | 80 |
|---|---|---|---|---|
| LLZTO | 9.07 ×10-5 | 4.637 ×10-4 | 1.18 ×10-3 | 7.67 ×10-3 |
| 液体电解液 | 2.86 ×10-3 | 8.51 ×10-3 | 1.207 ×10-2 | 1.396 ×10-2 |
2.2 液体电解液修饰LLZTO电解质前后的形貌成分变化
图2为LLZTO石榴石电解质表面未滴加和滴加电解液的表面和截面SEM照片,如图2(a)所示,LLZTO表面未滴加液体电解液的表面形貌出现很多颗粒状的残留物和微孔,颗粒残留物存在可能是磨片减薄过程中残留的LLZTO颗粒,同时也说明其表面是极其不平整的,微孔的出现可能是因为烧结过程中陶瓷片出现的收缩导致致密度低的原因。因此,微观下LLZTO电解质表面的不平整也进一步证明了电解质与电极材料之间的空隙是界面问题的主要根源。当LLZTO表面滴加10 μL液体电解液待其干燥后,如图2(b)所示,其表面形貌与未滴加电解液的表面形貌区别明显,其表面形貌有一层明显的界面层,残留的LLZTO细小颗粒及微孔基本消失。进一步地,通过SEM观察LLZTO石榴石电解质表面未滴加和滴加电解液的截面形貌,如图2(c)所示,LLZTO石榴石电解质表面出现一层很薄的颗粒状残留物层和明显的孔隙,与表面观察到的现象是一致的。同时地,滴加电解液干燥后的截面形貌如图2(d)所示,通过液体电解液浸润,LLZTO表面的孔道得到有效填充[图2(b)],且在其表面能够看到一层明显的界面层,这些结果表明液体电解液能够很好地渗透到LLZTO电解质内部,有效降低陶瓷中的孔隙。
图2
图2
(a), (b) LLZTO石榴石电解质表面未滴加和滴加电解液的表面SEM照片;(c), (d)LLZTO石榴石电解质表面未滴加和滴加电解液的截面SEM照片
Fig. 2
(a), (b) top-view SEM images of LLZTO garnet electrolyte surface without and with dripping electrolyte; (c), (d) cross-section SEM images of the LLZTO garnet electrolyte surface without and with dripping electrolyte
为了进一步确定未滴加和滴加电解液的石榴石电解质表面和截面的成分变化,我们对LLZTO石榴石电解质表面滴加/未滴加电解液的表面和截面进行EDS分析,图3为LLZTO石榴石电解质表面滴加电解液的表面SEM照片及对应元素的EDS照片,如图3所示,F、P元素均匀地分布在整个测试范围内,表明滴加的电解液能够均匀分散在整个LLZTO电解质表面,具有优良的润湿性。相对应的LLZTO石榴石电解质中的Zr、La和O元素也展示了优良的分散性能。图4为LLZTO石榴石电解质表面滴加电解液的截面SEM照片及对应元素的EDS照片,如图4所示,F、P元素均匀地分布在LLZTO电解质内部被液体电解液浸润的孔隙,这说明了LLZTO与电解液有好的浸润性和它的孔隙被电解液有效填充,且LLZTO石榴石电解质中的Zr、La和O元素也均匀分布在它的截面,进一步说明了电解液优良的浸润分散性。
图3
图3
(a) LLZTO石榴石电解质表面滴加电解液的表面SEM照片以及相应的F(b)、P(c)、Zr(d)、La(e)和O(f)元素的EDS照片
Fig. 3
(a) top-view SEM images of the LLZTO garnet eletrolyte surface dripping electrolyte and the EDS images of the corresponding F (b), P (c), Zr (d), La (e) and O (F) elements
图4
图4
(a) LLZTO石榴石电解质表面滴加电解液的截面SEM照片以及相应的F(b)、P(c)、Zr(d)、La(e)和O(f)元素的EDS照片
Fig. 4
(a) cross-section SEM images of the LLZTO garnet electrolyte with dripping electrolyte and the EDS images of the corresponding F (b), P (c), Zr (d), La (e), and O (F) elements
图5(a)为LLZTO石榴石电解质表面未滴加和滴加10 μL电解液的XRD图,由图可知,未滴加和滴加10 μL电解液的陶瓷片均为纯立方相的LLZTO,滴加了电解液的陶瓷片表面无明显的有关电解液成分的杂质衍射峰出现,一方面可能是滴加少量电解液与LLZTO无明显的副反应,另一方面可能是少量电解液在LLZTO表面干燥后形成的物质较少,背底峰(LLZTO)较强,无法达到XRD检测的标准量。进一步地,我们采取XPS对滴加电解液的陶瓷片表面进行分析,结果如图5(b)、(e)所示,XPS全谱图[图5(b)]显示Li、La、Zr、Ta、O、C、F、P元素存在LLZTO表面,其中Li、La、Zr、Ta和O元素主要来源于LLZTO。此外,C、P和F元素的高分辨峰如图5(c)、(e)所示,C元素的高分辨XPS图谱分析发现LLZTO表面成分中含有化合物LiCO3和C=O、C-O、C-H碳键;P元素的高分辨XPS图谱证明LLZTO表面成分含有化合物LiPFx,F元素的高分辨XPS图谱说明LLZTO表面成分含有化合物LiPFx和LiF,其中LiPFx和LiF主要是来源于电解液中的锂盐,LiCO3则可能是LLZTO与空气中的水分形成的反应物。因此,滴加电解液的陶瓷片表面可能含有化合物LiCO3、LiPFx、LiF和C=O、C-O、C-H碳键。
图5
图5
(a) LLZTO石榴石电解质表面未滴加和滴加电解液的XRD图;(b) LLZTO石榴石电解质表面滴加电解液后表面的XPS全谱图;(b~d) LLZTO石榴石电解质表面滴加电解液后XPS谱图中C(c),P(d)和F(e)元素的高分辨图
Fig. 5
(a) XRD patterns of LLZTO garnet electrolyte surface without and with dripping electrolyte; (b) XPS full spectrum of LLZTO garnet electrolyte surface after dripping electrolyte; (b~d) high-resolution spectra of C(c), P(d) and F(e) elements in XPS full spectrum after dripping electrolyte on the LLZTO garnet electrolyte surface
2.3 液体电解液改性LLZTO石榴石电解质界面的对称电池电化学性能表征
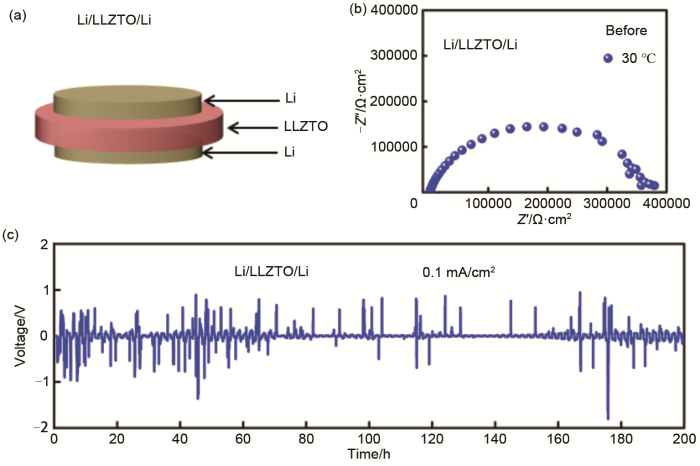
图6(a)为LLZTO固态对称电池的示意图,在LLZTO石榴石电解质两面贴上锂片,其中LLZTO的直径为14.86 mm,锂片的直径为14 mm,组装成扣式的CR2032电池,简称为Li/LLZTO/Li电池。图6(b)为Li/LLZTO/Li固态对称电池在30 ℃下的EIS阻抗图谱,可以发现其阻抗值为370000 Ω/cm2左右,说明固态电池中石榴石电解质与锂金属之间存在非常巨大的界面阻抗。为了进一步测试Li/LLZTO/Li固态对称电池的电化学性能,我们将Li/LLZTO/Li固态对称电池在0.1 mA/cm2电流密度下进行恒流充放电测试,如图6(c)所示,对称电池的极化电压随着循环的延长波动较大,说明Li/LLZTO/Li固态对称电池循环稳定性差,石榴石电解质与锂金属的界面极其不稳定,容易引起短路,对称电池难以进行正常的充放电循环。
图6
图6
(a) Li/LLZTO/Li对称电池的构型示意图;(b) 循环前Li/LLZTO/Li对称电池在不同温度下的EIS图;(c) Li/LLZTO/Li对称电池在0.1 mA/cm2的电流密度下恒流充放电稳定性能
Fig. 6
(a) schematic diagram of Li/LLZTO/Li symmetric battery configuration; (b) Nyquist plot of Li/LLZTO/Li symmetric battery at different temperatures before cycling; (c) galvanostatic cycling performance of Li/LLZTO/Li symmetric battery at 0.1 mA·cm-2
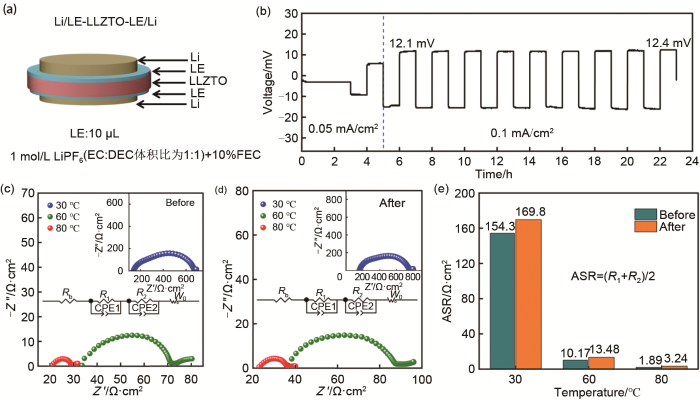
为了进一步验证液体电解液作为界面修饰层改善LLZTO与锂金属负极的效果,如图7(a)所示,其为电解液改性固态电池界面的示意图,首先将定量的液体电解液(LE)滴在LLZTO一侧,静置一段时间后然后贴上锂片,接着另一侧重复上述过程,最后复合形成LE-LLZTO-LE电解质,组装成扣式的CR2032电池,其中LE作为界面层起到减少界面阻抗和稳定界面的作用。图7(b)为Li/LE-LLZTO-LE/Li对称电池在0.05 mA/cm2和0.1 mA/cm2电流密度下的恒流充放电测试,其中设置小的电流密度0.05 mA/cm2循环1周,主要是为了活化及稳定陶瓷电解质与锂金属之间的液体电解液界面,使该界面更加稳定。Li/LE-LLZTO-LE/Li对称电池的电流密度随着从0.05到0.1 mA/cm2渐渐增大,极化电压随着电流密度的增加而逐渐增大。当电流密度增大到0.1 mA/cm2,电池的极化电压为12.1 mV,随着时间延长到23 h,电池的极化电压增大到12.4 mV,极化电压增大的原因是随着循环的延长液体电解液与锂负极和LLZTO固态电解质反应形成的SEI膜变厚,从而导致陶瓷电解质与锂金属之间的界面阻抗增大。
图7
图7
(a) Li/LE-LLZTO-LE/Li对称电池的构型示意图;(b) Li/LE-LLZTO-LE/Li对称电池在0.05 mA/cm2和0.1 mA/cm2的恒流循环性能;(c) 循环前Li/LE-LLZTO-LE/Li对称电池在不同温度下的EIS图;(d) 循环后 Li/LE-LLZTO-LE/Li对称电池在不同温度下的EIS图;(e) 对称电池循环前后石榴石电解质与锂金属(Li/LE/LLZTO)在不同温度下的面电阻比较
Fig. 7
(a) schematic diagram of Li/LE-LLZTO-LE/Li symmetric battery configuration; (b) galvanostatic cycling performance of Li/LE-LLZTO-LE/Li symmetric battery at 0.05 mA·cm-2 and 0.1 mA·cm-2; (c) Nyquist plots of Li/LE-LLZTO-LE/Li symmetric battery at different temperatures before cycle; (d) Nyquist plots of Li/LE-LLZTO-LE/Li symmetric battery at different temperatures after cycle; (e) comparison of areal specific resistance of garnet electrolyte and lithium metal (Li/LE/LLZTO) at different temperatures before and after symmetric battery cycle
图7(c)和(d)为不同温度下,Li/LE-LLZTO-LE/Li固态对称电池在0.1 mA/cm2电流密度下循环前后的EIS阻抗图谱,Rb对应于电解质的体电阻,R1对应于液体电解液与电解质的界面电阻,CPE1对应于液体电解液与电解质的界面的电容,R2对应于液体电解液与锂金属的界面阻抗,CPE2对应于液体电解液与锂金属的界面电容。表1和表2为不同温度下对称锂电池循环前后对应EIS谱的拟合结果,30 ℃时,电池循环前后的体电阻(Rb)分别为83.95 Ω·cm2和95.33 Ω·cm2,电池循环前后液体电解液与电解质的界面电阻(R1)分别为51.98 Ω·cm2和77.20 Ω·cm2,电池循环前后液体电解液与锂金属的界面电阻(R2)分别为256.8 Ω·cm2和262.4 Ω·cm2;60 ℃时,电池循环前后的体电阻(Rb)分别为21.30 Ω·cm2和23.96 Ω·cm2,电池循环前后液体电解液与电解质的界面电阻(R1)分别为5.490 Ω·cm2和3.848 Ω·cm2,电池循环前后液体电解液与锂金属的界面电阻(R2)分别为14.86 Ω·cm2和23.13 Ω·cm2;80 ℃时,电池循环前后的体电阻(Rb)分别为13.03 Ω·cm2和14.48 Ω·cm2,电池循环前后液体电解液与电解质的界面电阻(R1)分别为1.139 Ω·cm2和1.829 Ω·cm2,电池循环前后液体电解液与锂金属的界面电阻(R2)分别为2.656 Ω·cm2和4.666 Ω·cm2;因为固态对称电池两侧存在四个界面阻抗[两个电解液与电解质的界面电阻(即R1值)和两个电解液与锂金属的界面电阻(即R2值)],所以固态电解质与锂金属的界面阻抗计算公式为(R1+R2)/2,通过换算得到的80 ℃时循环前后固态电解质与锂金属的界面阻抗分别为1.89 Ω·cm2和3.24 Ω·cm2[图7(e)]。这些结果说明随温度的增加界面阻抗明显降低,表明通过滴加液体电解液使得电解质与锂负极间的界面接触得到了有效的改善,电解液有效地改性了电解质与锂负极的界面。随着温度从30 ℃升高到80 ℃,反应动力学加快,锂离子迁移越过界面的速度加快,所以不管是电池循环前还是循环后对称电池整体的界面电阻在不断变小。进一步对比不同温度下对称电池在循环前后的阻抗变化,发现对称电池在循环后阻抗均有相应增加,高温下循环后界面阻抗的增幅比低温条件下的大,在30 ℃下,面电阻从循环前的154.3 Ω·cm2增加到循环后的169.8 Ω·cm2,增幅为10.11%;在60 ℃下,面电阻从循环前的10.17 Ω·cm2增加到循环后的13.48 Ω·cm2,增幅为32.55%;在80 ℃下,面电阻从循环前的1.89 Ω·cm2增加到循环后的3.24 Ω·cm2,增幅为71.43%[图7(e)],这也进一步说明了随着温度的升高,高温条件下液体电解液与LLZTO或者锂金属负极之间副反应增加,界面反应加快,导致界面膜的厚度增加,从而使得对称电池极化逐渐增强和极化电压增大。
表2 循环前的Li/LE-LLZTO-LE/Li对称电池在不同温度下EIS谱的拟合结果
Table 2
| 温度/℃ | Rb/Ω·cm2 | R1/Ω·cm2 | CPE1/F·cm2 | R2/Ω·cm2 | CPE2/F·cm2 |
|---|---|---|---|---|---|
| 30 | 83.95 | 51.98 | 0.9975 | 256.8 | 0.7789 |
| 60 | 21.30 | 5.49 | 1.372 | 14.86 | 0.9705 |
| 80 | 13.03 | 1.139 | 1.404 | 2.656 | 1.014 |
表3 循环后的Li/LE-LLZTO-LE/Li对称电池在不同温度下EIS谱的拟合结果
Table 3
| 温度/℃ | Rb/Ω·cm2 | R1/Ω·cm2 | CPE1/F·cm2 | R2/Ω·cm2 | CPE2/F·cm2 |
|---|---|---|---|---|---|
| 30 | 95.33 | 77.20 | 0.99864 | 262.40 | 0.77642 |
| 60 | 23.96 | 3.848 | 1.295 | 23.13 | 0.81194 |
| 80 | 14.48 | 1.829 | 1.328 | 4.666 | 0.92066 |
2.4 Li/LE-LLZTO-LE/Li对称电池长循环稳定性和循环前不同静置时间的EIS及其界面分析
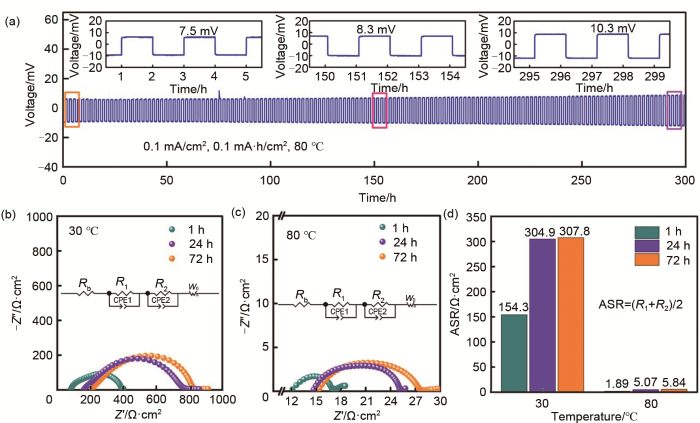
图8(a)为Li/LE-LLZTO-LE/Li对称电池在0.1 mA/cm2电流密度下的恒流充放电循环稳定性测试,如图所示,Li/LE-LLZTO-LE/Li对称电池在3~4 h时,电池的极化电压为7.5 mV;当循环时间延长到151~152 h,电池的极化电压增大到8.3 mV;随着循环时间延长到297~298 h,电池的极化电压增大为10.3 mV,极化电压增大的原因是随着循环的延长液体电解液与锂负极和LLZTO固态电解质反应形成的SEI膜变厚,从而导致陶瓷电解质与锂金属之间的界面阻抗增大,根据欧姆定律可知电池的极化电压也相应地变大,但循环300 h后对称电池整体的电阻变化不是很大,说明形成的SEI膜具有一定的稳定性。
图8
图8
(a) Li/LE-LLZTO-LE/Li对称电池在0.1 mA/cm2的恒流循环性能;(b) Li/LE-LLZTO-LE/Li对称电池在30 ℃下不同静置时间的EIS图;(c) Li/LE-LLZTO-LE/Li对称电池在80 ℃下不同静置时间的EIS图;(e) 不同静置时间的Li/LE-LLZTO-LE/Li对称电池中石榴石电解质与锂金属(Li/LE/LLZTO)在30 ℃和80 ℃温度下的面电阻比较
Fig. 8
(a) galvanostatic cycling performance of Li/LE-LLZTO-LE/Li symmetric battery at 0.1 mA·cm-2; (b) Nyquist plots of Li/LE-LLZTO-LE/Li symmetric batteries at 30 ℃ with different standing times before cycling; (c) Nyquist plots of Li/LE-LLZTO-LE/Li symmetric batteries at 80 ℃ with different standing times before cycling; (d) comparison of areal specific resistance of garnet electrolyte and lithium metal (Li/LE/LLZTO) at 30 ℃ and 80 ℃ with different standing times before cycling
此外,为了进一步研究循环前Li/LE-LLZTO-LE/Li对称电池在不同静置时间和温度下的EIS变化及其界面阻抗变化,我们将组装好的对称电池放在30 ℃和80 ℃下分别静置1、24和72 h测试其阻抗变化。图8(b)和(c)为测试得到的EIS图谱,表4为图8(b)和(c)对应EIS谱的拟合结果,30 ℃时,静置1、24和72 h后对称电池的体电阻(Rb)分别为83.95、215.96和235.07 Ω·cm2,对称电池中液体电解液与电解质的界面电阻(R1)分别为51.98、49.34和50.16 Ω·cm2,对称电池中液体电解液与锂金属的界面电阻(R2)分别为256.8、560.66和565.46 Ω·cm2;80℃时,静置1、24和72 h后对称电池的体电阻(Rb)分别为13.03、15.06和15.78 Ω·cm2,对称电池中液体电解液与电解质的界面电阻(R1)分别为1.139、2.524和2.649 Ω·cm2,对称电池中液体电解液与锂金属的界面电阻(R2)分别为2.656、7.623和9.031 Ω·cm2;通过换算得到循环前对称电池在30 ℃下分别静置1、24和72 h的固态电解质与锂金属界面阻抗分别为154.3、304.9和307.8 Ω·cm2,在80 ℃下分别静置1、24和72 h的固态电解质与锂金属界面阻抗分别为1.89、5.07和5.84 Ω·cm2[图8(d)]。这些结果说明循环前对称电池的静置时间对电池的界面阻抗有较大影响,不管在30 ℃或者80 ℃下,对比静置1 h到24 h或72 h期间,电池的界面阻抗增幅最大,而静置24 h与72 h后电池的界面阻抗增幅不大,这可能是因为静置24 h后液体电解液与锂负极和LLZTO固态电解质形成的原始SEI膜趋于稳定。对比30 ℃和80 ℃下,高温80 ℃下,静置24~72 h对称电池界面阻抗的增幅比在30 ℃下大[图8(d)],这说明随着温度的升高,反应动力学加快,静置时液体电解液与LLZTO或者锂金属负极之间副反应增加,导致界面膜的厚度增加,从而使得对称电池的面电阻增加。因此,循环前电池需要静置一段时间待其界面阻抗相对稳定后测试。
表4 循环前的Li/LE-LLZTO-LE/Li对称电池在不同静置时间和不同温度下EIS谱的拟合结果
Table 4
| 静置时间/h | 温度/°C | Rb/Ω·cm2 | R1/Ω·cm2 | CPE1/F·cm2 | R2/Ω·cm2 | CPE2/F·cm2 |
|---|---|---|---|---|---|---|
| 1 | 30 | 83.95 | 51.98 | 0.9975 | 256.8 | 0.7789 |
| 80 | 13.03 | 1.139 | 1.404 | 2.656 | 1.014 | |
| 24 | 30 | 215.96 | 49.34 | 0.92438 | 560.66 | 0.92438 |
| 80 | 15.06 | 2.524 | 1.114 | 7.623 | 0.80257 | |
| 72 | 30 | 235.07 | 50.16 | 0.92267 | 565.46 | 0.79041 |
| 80 | 15.78 | 2.649 | 1.116 | 9.031 | 0.76511 |
3 结语
本文通过将液体电解液滴加在LLZTO固体电解质表面,从而有效降低LLZTO石榴石电解质与锂负极间的界面阻抗,实现锂负极与LLZTO间的稳定兼容。
(1)液体电解液滴加在LLZTO固态电解质表面,液体电解质不仅能够有效填充陶瓷电解质的孔隙,而且能够润湿LLZTO电解质表面,提高其与电极材料的兼容性;
(2)液体电解液极大地改善了石榴型电解质与锂负极的界面阻抗,随着测试温度的不断增加,滴加液体电解液的LLZTO电解质与锂负极间的界面阻抗降低。在80 ℃的情况下,石榴石型电解质与锂负极的面电阻为1.89 Ω·cm2,循环后的该面阻抗为3.24 Ω·cm2。
参考文献